Aujourd’hui sur le marché des spectromètres XRF portables on trouve deux technologies : les analyseurs avec un tube X et les analyseurs avec une source radioactive.
Pour trier des métaux sur un parc à ferrailles on utilise un appareil XRF à tube X comme le FEnX-T tandis que pour détecter du plomb dans les peintures, on utilise un appareil XRF à source radioactive comme le FEnX2.
Dans cet article, nous vous expliquons la différence entre les deux technologies et pourquoi on utilise un spectromètre à source radioactive pour réaliser les diagnostics plomb.
Dans un premier temps, nous pouvons revoir les notions d’atomes, de couches électroniques, de technologie XRF.
L’atome et les couches électroniques
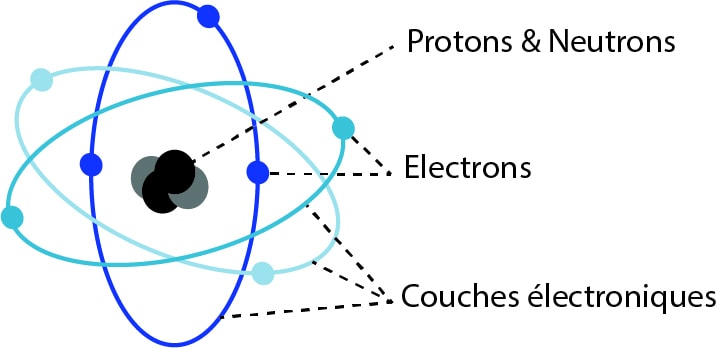
Un atome est composé d’un noyau central et d’électrons qui gravitent autour du noyau sur différentes couches électroniques ou orbites énergétiques.
Chaque couche a un niveau énergétique correspondant.
L’atome peut aussi être illustré de la manière suivante avec un noyau et les couches K, L, M :
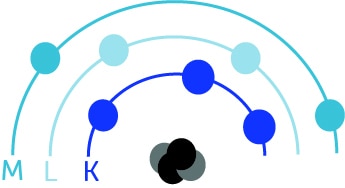
La couche la plus proche du noyau est la couche K.
Les électrons cherchent constamment à rester sur leur couche électronique initiale (K, L ou M).
Pour rester en orbite sur sa couche, un électron a besoin d’une énergie de liaison. Et plus la couche est proche du noyau, plus l’énergie requise pour rester dessus est élevée.
Plus un atome est lourd, plus il possède d’électrons et plus il possède de couches remplies.
Le plomb, un atome lourd
On dit de l’atome de plomb que c’est un atome lourd car il possède beaucoup d’électrons et beaucoup de couches remplies. Il se positionne à la 82e place dans le tableau périodique.
Focus sur les couches K et L du plomb
Dans le cas de l’atome de plomb, un électron d’une couche K va avoir besoin d’une énergie entre 74 et 85 keV pour rester en orbite dessus.
Un électron d’une couche L aura besoin lui d’une énergie entre 10 et 12 keV pour rester en orbite dessus.
Maintenant que les notions d’atomes et de couches sont éclaircies, la technologie XRF peut être rappelée.
Détecter un élément dans un échantillon avec la technologie XRF
Pour détecter un élément dans un échantillon – du plomb dans les peintures par exemple – on cherche à arracher les électrons de leurs couches grâce aux rayonnements émis par le spectromètre.
Pourquoi arracher ces électrons ?
En arrachant un électron de sa couche, un trou se crée. On dit alors que l’atome est instable.
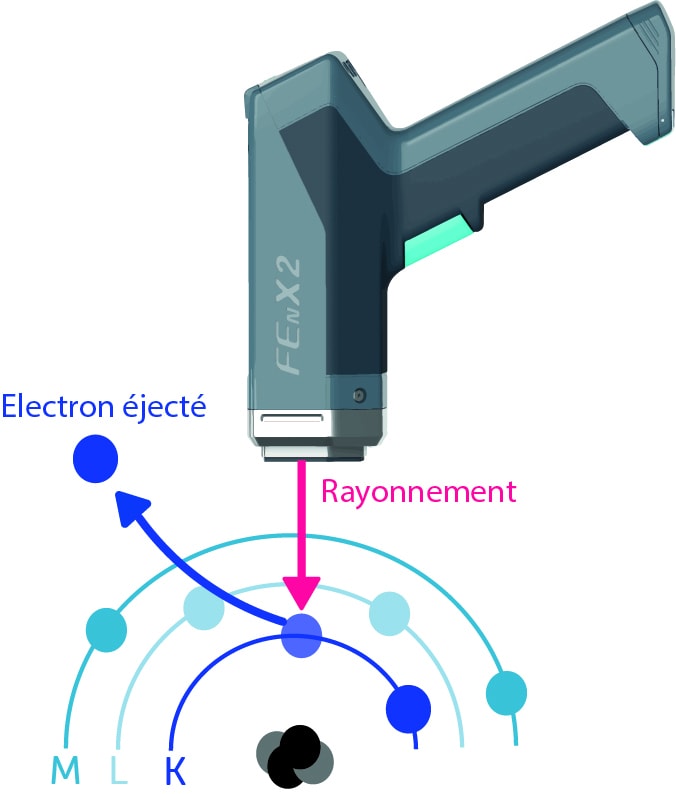
Et les couches internes vont chercher à se réorganiser en récupérant des électrons des couches supérieures pour combler le trou créé et ainsi retrouver un état stable. Ce mouvement d’électrons entre les couches entraîne une émission d’énergie sous forme de rayons X qu’on appelle la fluorescence X. C’est la différence d’énergie entre les 2 couches.
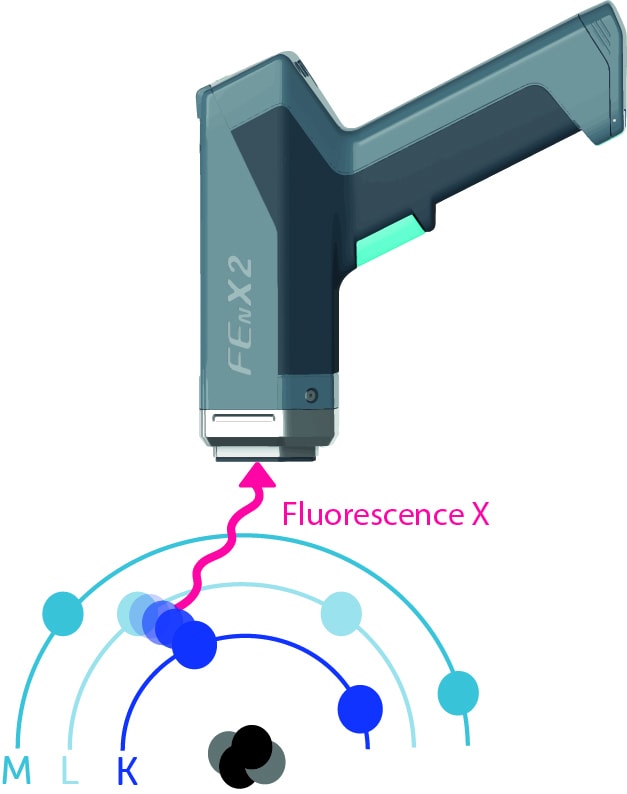
Ces énergies seront captées par le détecteur du spectromètre : elles vont créer un signal électrique qui est mis en forme pour générer un spectre.
Les raies spectrales K, L, M correspondent à la collecte des différents rayonnements de fluorescence X émis par la matière : un électron qui est arraché de la couche K participera à former la raie spectrale K.
Pour arracher un électron de sa couche, il faut une énergie supérieure à celle-ci. Dans la figure n°1, il faut que l’énergie émise par l’appareil soit supérieure à celle de la couche K.
Les notions d’atomes, de raies spectrales et de fluorescence X sont rappelées. La différence entre un appareil à tube X et un appareil à source peut être expliquée.
Quelle différence entre un appareil à tube X et un appareil à source radioactive ?
Actuellement un spectromètre XRF peut renfermer un tube à rayons X d’énergie allant jusqu’à 50 kV. C’est le cas par exemple du Niton XL5 Plus.
Un spectromètre XRF, destiné à l’analyse du plomb dans la peinture, peut renfermer une source radioactive Cadmium 109 (FEnX), ou une source Cobalt 57 (Pb200i). L’énergie maximale émise par une source Cadmium 109 est d’environ 88 keV, celle d’une source Cobalt est de 120 keV.
La différence est donc l’énergie : l’énergie d’émission d’un spectromètre à source est plus importante que celle d’un spectromètre à tube X.
Ainsi, en reprenant l’exemple du Plomb, pour arracher les électrons sur la couche électronique K, il est indispensable que l’énergie émise par le spectromètre soit supérieure à l’énergie des raies K du Plomb (entre 74 keV et 85keV).
Mais pourquoi vouloir analyser les raies K pour détecter le plomb dans les peintures ?
Dans l’arrêté du 19 août 2011 relatif au constat de risque d’exposition au plomb, il est stipulé que « Des mesures de concentration en plomb des revêtements sont réalisées pour chaque unité de diagnostic. Elles sont effectuées avec un appareil portable à fluorescence X capable d’analyser au moins la raie K du spectre de fluorescence émis en réponse par le plomb. »
Dans un avis de l’Afsse (Agence française de sécurité sanitaire environnementale) de 2005 concernant la détection du plomb dans les peintures anciennes, il est expliqué que « La mesure du spectre de fluorescence X d’un élément peut être affectée […] C’est le cas lorsque le plomb est situé en profondeur ou recouvert d’une ou plusieurs couches comportant un ou des éléments interférents ».
Concrètement : Si une couche de peinture contenant du plomb est recouverte par du papier peint (ou tout autre revêtement d’épaisseur significative), il peut être important d’analyser les raies K.
Si on analyse uniquement les couches L, la fluorescence X correspondante pourrait être altérée ou occultée par le revêtement recouvrant la couche de peinture au plomb.
L’analyse spectrale résultant uniquement des raies L pourrait donc être faussée.
Avec un spectromètre XRF à tube, le risque est alors de donner un faux négatif, c’est-à-dire que le résultat montrerait qu’il n’y a pas de plomb alors qu’il y en a sous le papier peint (ou sous le revêtement d’épaisseur significative).
C’est pourquoi, la réglementation française exige l’utilisation d’un spectromètre capable d’analyser la raie K du spectre de fluorescence émis en réponse par le plomb.

