Toute la matière qui nous entoure est composée d’atomes. Par exemple, un lingot d’or est constitué d’atomes d’or.
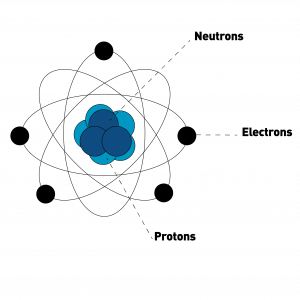
Un atome se compose de 2 choses :
- un noyau central (composé lui, de protons et neutrons)
- des électrons qui tournent autour du noyau sur différentes couches en fonction de la taille de l’atome.
Les protons et les neutrons sont ce que l’on appelle des nucléons.
Dans son état fondamental, l’atome est électriquement neutre. Il possède autant d’électrons que de protons.
Le noyau de l’atome a une charge positive :
Les protons sont de charge positive et les neutrons de charge nulle.
Autour du noyau, les électrons sont de charge négative.
Représentation symbolique de l’atome
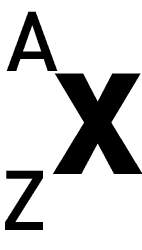
Z et A caractérisent l’atome. X, c’est le symbole de l’élément
Z = numéro atomique, nombre de protons
A = nombre de masse, nombre de nucléons (protons + neutrons)
Analyse élémentaire
Élémentaire mon cher Watson ! Mais qu’est-ce qu’un élément ?
Les atomes forment des éléments. Chaque élément possède un nombre unique de proton.
Mendeleïev a inventé une manière intelligente de classer tous les composants de la matière dans un tableau, c’est la classification périodique des éléments.
Les éléments sont classés par masse croissante. Les éléments en bas du tableau, sont plus massifs, ils sont plus lourds que les éléments en haut du tableau.
En fonction de la taille de l’atome, les électrons vont graviter autour du noyau sur différentes couches électroniques. Plus un atome est lourd, plus il possède d’électrons, plus il possède d’orbites électroniques. Une ligne du tableau correspond donc à une couche électronique supplémentaire.
Le tableau périodique a été créé en 1869 par Dimitri Mendeleïev.

Pour aller plus loin…
Un nucléide, c’est une espèce d’atome (ou de noyau atomique) caractérisé par le nombre de protons et de neutrons qu’il contient ainsi que par l’état d’énergie nucléaire dans lequel il se trouve.
Les nucléides qui ont le même nombre de protons mais un nombre différent de neutrons sont des isotopes. Un élément peut avoir plusieurs isotopes. En général, ils ont des propriétés chimiques identiques mais des propriétés physiques différentes.
Exemple : l’hydrogène a 3 isotopes
- L’hydrogène classique H : 1 proton, 0 neutron
- L’hydrogène 2H, le deutérium : 1 proton, 1 neutron
- L’hydrogène 3H, le tritium : 1 proton, 2 neutrons
Si l’isotope d’un élément est radioactif, alors on l’appelle radionucléide. Exemple : Uranium 238, iode 131.
Histoire de la physique quantique : l’atome
Atome, ça vient du grec atomos, qui signifie insécable, indivisible.
Il y a eu une évolution avant d’arriver à la représentation de l’atome que l’on connaît aujourd’hui.
Un atome, ça ressemble à quoi ?

Joseph John Thomson fut l’un des premiers à dessiner l’atome.
Nous sommes alors en 1897.
C’est le « plum pudding ».
L’atome serait une grosse boule de charge positive dans laquelle il y a des électrons de charge négatives qui rendent l’atome électriquement neutre.
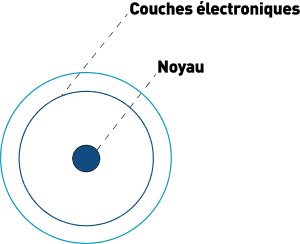
En 1908, Rutherford, fait une nouvelle expérience avec une feuille d’or et conclut que l’atome est creux. Qu’il est essentiellement constitué de vide.
En 1913, il arrive à déterminer la taille du noyau de l’atome : 10-15 m. Comparé à l’atome qui fait 10-10m, le noyau est nettement plus petit. Pour illustrer cet ordre de grandeur : si une fourmi était un noyau, alors un stade serait l’atome !
Rutherford dit que les électrons tournent autour du noyau à des emplacements déterminés avec un électron par orbite.
En 1933, Chadwick découvre le neutron. Le noyau n’est pas indivisible car constitué de protons et de neutrons :

La masse de l’atome, à 99.9%, est dans le noyau. Les électrons ne pèsent presque rien.
L’effet photoélectrique
En 1888, Heinrich Hertz, constate qu’en dirigeant de la lumière sur un métal, il produit de l’électricité.
Einstein montre que les électrons peuvent être arrachés au métal quand on leur transmet une énergie supérieure à celle qui les lie au métal.
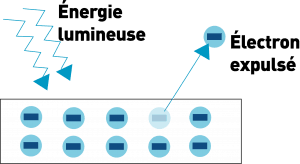
La lumière peut transmettre de l’énergie.
Elle est donc composée de particules.
Einstein les appelle les particules de lumière, des quanta de lumière.
C’est Lewis qui les baptisera les photons.
Physique quantique et physique classique
Pour résumer, la physique classique, ce sont les découvertes faites avant le 19e siècle et qui sont applicables au niveau macroscopique.
La physique quantique (le nom vient de la découverte des quanta), ce sont les découvertes plus modernes qui vont s’appliquer à l’infiniment petit.
Il existe 3 niveaux en physique :
- Univers (infiniment grand qui comprend la galaxie, les planètes),
- Macroscopique (notre échelle)
- Microscopique (l’infiniment petit, on ne peut le voir à l’œil nu).
Pour en découvrir plus sur le sujet de la physique quantique, nous vous conseillons ce livre de Vincent Rollet qui vulgarise bien le sujet, “la physique quantique (enfin) expliquée simplement.”
Le modèle de BOHR
Ce modèle est important pour comprendre la technologie de nos spectromètres à fluorescence X et LIBS.
20 ans avant Chadwick, Bohr étudie le comportement des électrons qui gravitent autour du noyau.
Bohr découvre que les électrons se situent sur une couche électronique définie en fonction de la quantité d’énergie qu’ils possèdent. Autrement dit, tous les électrons d’une couche électronique ont la même quantité d’énergie.
Il est possible de déplacer les électrons d’une couche à une autre en leur faisant gagner ou perdre de l’énergie. Par exemple, un électron peut basculer d’une couche interne vers une couche externe par un gain d’énergie. Ce gain peut s’effectuer de façon photonique (projection de photon sur l’atome). C’est l’absorption.

L’électron s’éloigne du noyau. C’est un état « instable » ou « excité ».
Pour que l’atome revienne à son état fondamental, l’électron va chercher à reprendre sa place sur son orbite d’origine. Pour ce faire, il doit perdre de l’énergie.
L’atome émet donc un photon dans une direction aléatoire. C’est l’émission spontanée.

Nous avons approfondi les éléments clés pour comprendre simplement ce qu’est la physique quantique.
Ceci va nous permettre d’expliquer comment fonctionne la fluorescence X, technique analytique utilisée avec nos spectromètres FEnX-T, XL2, XL3 et XL5.

